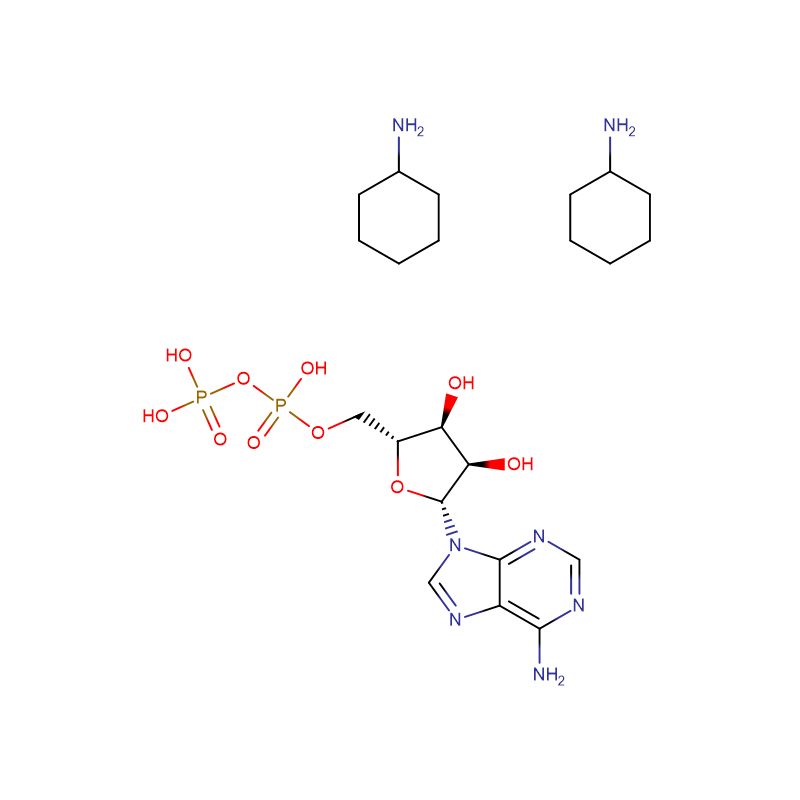
adenosiin 5'-difosfaat di(monotsükloheksüülammoonium Cas: 102029-87-8 99% valge pulber
| Kataloogi number | XD90159 |
| tootenimi | adenosiin-5'-difosfaatdi(monotsükloheksüülammoonium |
| CAS | 102029-87-8 |
| Molekulaarvalem | C10H15N5O10P2·2C6H13N |
| Molekulmass | 625,55 |
| Salvestusruumi üksikasjad | 2 kuni 8 °C |
| Harmoneeritud tariifikoodeks |
Toote spetsifikatsioon
| Välimus | Valge pulber |
| Assay | 99% |
1. Uurida, kas adenosiindifosfaadist (ADP) pärinev adenosiin võib pärssida trombotsüütide agregatsiooni, eriti P2Y12 antagonisti juuresolekul, kus ADP mõju P2Y12 retseptorile oleks ära hoitud. Trombotsüütide agregatsiooni mõõdeti vastusena trombiini retseptori aktivaatorile. peptiid trombotsüütide loendamisega trombotsüütide rikkas plasmas (PRP) ja täisveres ADP ja P2Y12 antagonistide kangreloori, prasugreeli aktiivse metaboliidi ja tikagreloori juuresolekul.P2Y12 antagonisti juuresolekul inhibeeris PRP eelinkubatsioon ADP-ga agregatsiooni;selle efekti kaotas adenosiindeaminaas.Täisveres agregatsiooni pärssimist ei toimunud, välja arvatud juhul, kui dipüridamooli lisati adenosiini erütrotsüütidesse omastamise pärssimiseks.ADP mõju PRP-s ja täisveres replitseeriti adenosiini abil ja need olid otseselt seotud cAMP muutustega (hinnatud vasodilataatoriga stimuleeritud fosfoproteiini fosforüülimisega).Kõik tulemused olid samad, olenemata kasutatud P2Y12 antagonistist. ADP inhibeerib trombotsüütide agregatsiooni P2Y12 antagonisti juuresolekul, muundades adenosiiniks.Inhibeerimine toimub PRP-s, kuid mitte täisveres, välja arvatud juhul, kui adenosiini omastamine on inhibeeritud.Ükski uuritud P2Y12 antagonistidest ei kordanud läbiviidud katsetes dipüridamooli toimet.
2. ADP-d peetakse nõrgaks trombotsüütide agonistiks piiratud agregatsioonireaktsioonide tõttu, mida see in vitro rakuvälise Ca(2+) füsioloogilistel kontsentratsioonidel [(Ca(2+) )(o) ] kutsub esile.[Ca(2+) ](o) alandamine suurendab paradoksaalselt ADP poolt esile kutsutud agregatsiooni, mis on tingitud tromboksaani A(2) suurenenud tootmisest.Selles uuringus uuriti ektonukleotidaaside rolli trombotsüütide aktivatsiooni [Ca(2+)](o)-sõltuvuses.[Ca(2+) ](o) vähendamine millimolaarselt mikromolaarsele tasemele muutis ADP (10 μmol/l) poolt esile kutsutud trombotsüütide agregatsiooni mööduvast vastusest püsivaks vastuseks nii trombotsüütiderikkas plasmas kui ka pestud suspensioonis.Tromboksaani A(2) tootmise blokeerimine aspiriiniga ei mõjutanud seda [Ca(2+)](o) -sõltuvust.ADP lagunemise vältimine kaotas erinevused madala ja füsioloogilise [Ca(2+) ](o) vahel, mille tulemuseks oli tugev ja püsiv agregatsioon mõlemas olukorras.Ekstratsellulaarse ADP mõõtmised näitasid nii plasmas kui ka apüraasi sisaldavas soolalahuses vähenenud lagunemist mikromolaarses koguses võrreldes millimolaarse [Ca(2+) ](o) -ga.Nagu varem teatatud, suurenes tromboksaani A(2) teke madalal [Ca(2+) ](o) juures, kuid see ei sõltunud ektonukleotidaasi aktiivsusest(.) P2Y retseptori antagonistid cangrelor ja MRS2179 näitasid P2Y(12) retseptorite vajalikkust pideva ADP poolt esile kutsutud agregatsiooni jaoks, millel on väike roll P2Y(1) jaoks.Kokkuvõtteks võib öelda, et Ca(2+)-sõltuv ektonukleotidaasi aktiivsus on peamine tegur, mis määrab trombotsüütide agregatsiooni ulatuse ADP-ks ja seda tuleb P2Y retseptori aktiveerimise uuringutes kontrollida.