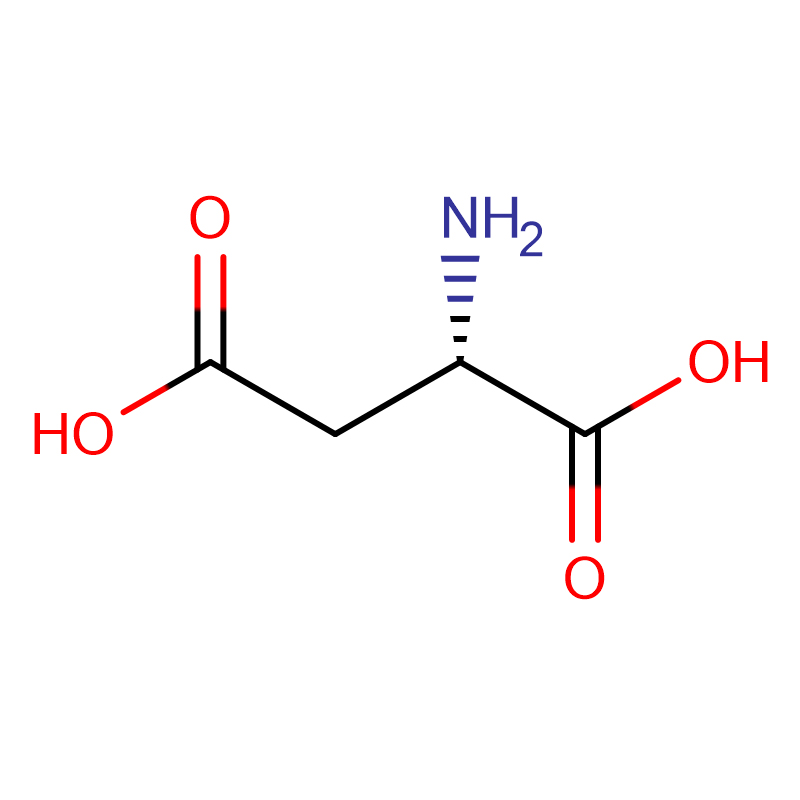
L-asparagiinhape CAS:56-84-8 99% Valge pulber
| Kataloogi number | XD90315 |
| tootenimi | D-asparagiinhape |
| CAS | 56-84-8 |
| Molekulaarvalem | C4H7NO4 |
| Molekulmass | 133.10 |
| Salvestusruumi üksikasjad | 2 kuni 8 °C |
| Harmoneeritud tariifikoodeks | 29224985 |
Toote spetsifikatsioon
| Välimus | Valge pulber |
| Analüüs | 99% |
| Hinne | USP34 |
| Spetsiifiline pöörlemine | +24,5 kuni +26 |
| Plii | <0,0005% |
| Kaod kuivamisel | <0,25% |
| Jäägid süttimisel | <0,1% |
EAAT2 glutamaadi transporter moodustab > 90% hipokampuse glutamaadi omastamisest.Kuigi EAAT2 ekspresseeritakse valdavalt astrotsüütides, leidub ~10% EAAT2 molekulidest aksoni otstes.Vaatamata madalamale EAAT2 ekspressioonitasemele glutamatergilistes terminalides, kui hipokampuse viilu inkubeeritakse madala kontsentratsiooniga d-aspartaadiga (EAAT2 substraat), koguvad aksoni terminalid d-aspartaati sama kiiresti kui astroglia.See tähendab seletamatut mittevastavust EAAT2 valgu jaotuse ja EAAT2-vahendatud transpordiaktiivsuse vahel.Üks hüpotees on, et (1) sisemise substraadi heterovahetus välise substraadiga on tunduvalt kiirem kui neto omastamine ja (2) terminalid soodustavad heterovahetust sisemise glutamaadi kõrge taseme tõttu.Praegu pole aga teada, kas heterovahetuse ja omastamise määrad on sarnased või erinevad.Selle probleemi lahendamiseks kasutasime kahe protsessi suhteliste kiiruste võrdlemiseks rottidel ja hiirtel taastatud süsteemi.Neto omastamine oli tundlik membraanipotentsiaali muutuste suhtes ja seda stimuleerisid välised läbilaskvad anioonid kooskõlas sidumata aniooni juhtivuse olemasoluga.Viimast kasutades demonstreerime ka, et heterovahetuse kiirus sõltub ka membraanipotentsiaalist.Lisaks viitavad meie andmed naatriumilekke olemasolule EAAT2-s.Lisades uued leiud meie eelmisesse EAAT2 glutamaadi omastamise mudelisse, ennustame, et vahetuse pingetundlikkus on põhjustatud pingest sõltuvast kolmandast Na (+) sidumisest.Lisaks näitavad nii meie katsed kui ka simulatsioonid, et neto omastamise ja heterovahetuse suhtelised määrad on EAAT2-s võrreldavad.