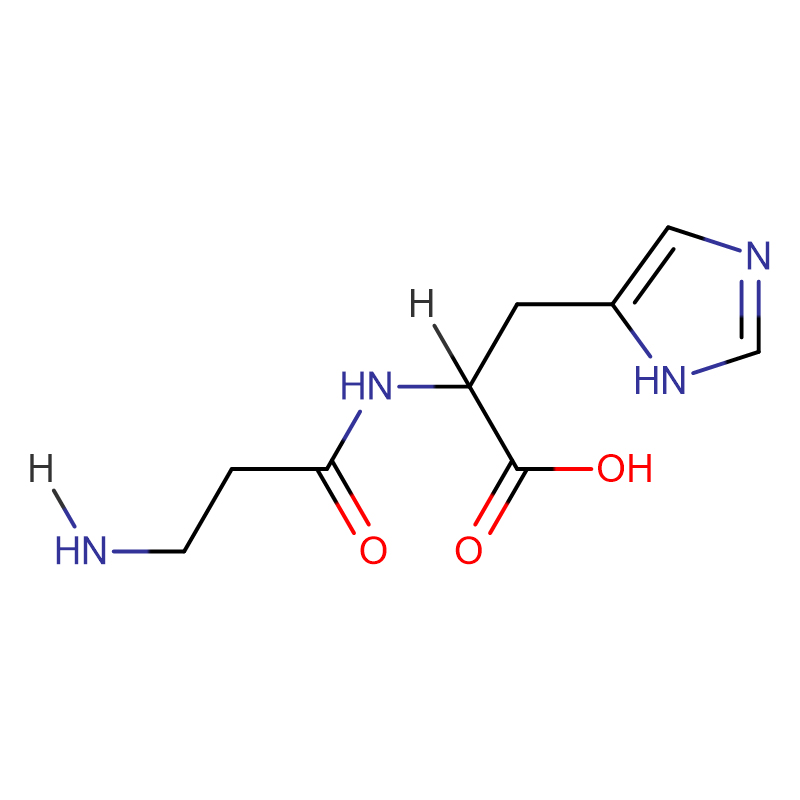
Ksantiinoksüdaas CAS:9002-17-9
| Kataloogi number | XD90392 |
| tootenimi | Ksantiini oksüdaas |
| CAS | 9002-17-9 |
| Molekulaarvalem | C18H29N5O10S2 |
| Molekulmass | 539,58 |
| Salvestusruumi üksikasjad | 2 kuni 8 °C |
| Harmoneeritud tariifikoodeks | 35079090 |
Toote spetsifikatsioon
| Välimus | Valge pulber |
Sigma retseptor 1 (σR1) on mitteopioidne transmembraanne valk, mis võib toimida molekulaarse chaperonina endoplasmaatilise retikulum-mitokondriaalse membraani juures.σR1 ligandid, nagu (+)-pentasotsiin [(+)-PTZ], tagavad märgatava võrkkesta neuroprotektsiooni in vivo ja in vitro.Hiljuti analüüsisime hiirte võrkkesta fenotüüpi, kellel puudus σR1 (σR1 KO), ja täheldasime võrkkesta normaalset morfoloogiat ja funktsiooni noortel hiirtel (5–30 nädalat), kuid vähendasime negatiivseid skotoopläve vastuseid (nSTR-sid), võrkkesta ganglionrakkude (RGC) kadu ja häireid. nägemisnärvi aksonitest, mis on kooskõlas võrkkesta sisemise düsfunktsiooniga 1 aasta pärast.Need andmed ajendasid meid kontrollima hüpoteesi, et σR1 võib olla kriitilise tähtsusega võrkkesta kroonilise stressi ennetamisel;kroonilise stressi mudelina kasutati diabeeti. Et teha kindlaks, kas σR1 on vajalik (+)-PTZ neuroprotektiivse toime jaoks, viidi metsiktüüpi (WT) ja σR1 KO hiirtelt eraldatud primaarsed RGC-d kokku ksantiin-ksantiinoksüdaasiga (10 µM: 2 mU/ml), et kutsuda esile oksüdatiivne stress (+)-PTZ juuresolekul või puudumisel.Rakusurma hinnati terminaalse desoksünukleotidüültransferaasi dUTP hüüdotsa märgistamise (TUNEL) analüüsiga.Kroonilise stressi mõju hindamiseks RGC funktsioonile indutseeriti diabeet 3-nädalastel C57BL/6 (WT) ja σR1 KO hiirtel, kasutades streptozototsiini, et anda neli rühma: WT mittediabeetiline (WT mitte-DB), WT diabeetik (WT-DB). ), σR1 KO mitte-DB ja σR1 KO-DB.Pärast 12-nädalast diabeeti, kui hiired olid 15-nädalased, registreeriti silmasisene rõhk (IOP), viidi läbi elektrofüsioloogilised testid (sealhulgas nSTR-de tuvastamine) ja võrkkesta histoloogilistes lõikudes loendati RGC-de arv. In vitro uuringud näitasid, et (+) -PTZ ei suutnud ära hoida σR1 KO hiirtelt kogutud RGC-de oksüdatiivsest stressist põhjustatud surma, kuid andis tugeva kaitse WT hiirtelt kogutud RGC-de surma eest.Diabeedist põhjustatud kroonilise stressi uuringutes oli neljas hiirerühmas mõõdetud IOP normi piires;siiski suurenes σR1 KO-DB hiirte silmasisene rõhk (16 ± 0,5 mmH g) võrreldes teiste testitud rühmadega (σR1 KO non-DB, WT non-DB, WT-DB: ~12 ± 0,6 mmHg) ).Elektrofüsioloogilise testimise osas olid σR1 KO mitte-DB hiirte nSTR-d 15. nädalal sarnased WT mitte-DB hiirtega;siiski olid need oluliselt madalamad σR1 KO-DB hiirtel (5 ± 1 µV) võrreldes teiste rühmadega, sealhulgas eriti σR1 KO-nonDB (12 ± 2 µV).Ootuspäraselt oli RGC-de arv σR1 KO mitte-DB hiirtel 15. nädalal sarnane WT mitte-DB hiirtega, kuid kroonilise diabeedi stressi korral oli σR1 KO-DB hiirte võrkkestas vähem RGC-sid. See on esimene aruanne. mis näitab ühemõtteliselt, et (+)-PTZ neuroprotektiivne toime nõuab σR1.σR1 KO hiirtel on noores eas normaalne võrkkesta struktuur ja funktsioon;diabeedi kroonilise stressi allutamisel kiireneb aga võrkkesta funktsionaalne defitsiit σR1 KO hiirtel nii, et ganglionrakkude düsfunktsiooni täheldatakse palju varasemas eas kui mittediabeetilistel σR1 KO hiirtel.Andmed toetavad hüpoteesi, et σR1 mängib võrkkesta stressi moduleerimisel võtmerolli ja võib olla võrkkesta haiguse oluline sihtmärk.